يتم تكوين المحاليل المختلفة من خلال الخلط بين المركبات والمواد والجزيئات ، حيث أن بعض المواد الكيميائية السائلة تكون قادرة على إذابة مواد أخرى صلبة ومن ثم الحصول على مخلوط ومحلول ذو فائدة كبيرة دون التأثير على أي من الخواص الكيميائية لتلك المواد ، وهناك عدد لا حصر له من المواد المذيبة مثل بعضأنواع المذيبات العضويةوالمذيبات غير العضوية ومنها الماء .
خواص الماء
المياه هي أحد أهم أسباب الحياة على وجه الأرض ، ولا يُمكن الاستغناء عنها ، وقد أشار كبار العلماء إلى أن خواص الماء تأتي على النحو التالي[1]:-المياه سائل عديم اللون ولا طعم ولا رائحة له .-يُمكن أن يتواجد الماء في الحالة السائلة في درجة حرارة الغرفة ، وعند انخفاض درجة الحرارة يتحول إلى الصورة الصلبة وهي الجليد ، يتبخر ويتحول إلى بخار مياه عند 100 درجة مئوية .-الماء في الحالة العادية يكون متعادل الحموضية حيث يكون الرقم الهيدروجيني له 7 تقريبًا ، وبالتالي ؛ فإن تناول المياه لن يؤثر على درجة الحموضة أو القاعدية في الدم والجسم عمومًا .-على عكس باقي المواد السائلة الأخرى التي تقل تزيد كثافتها ويقل حجمها عندما تتجمد ؛ فإن الماء عندما يتحول إلى جليد يزداد حجمه وتنخفض درجة كثافته .-يتميز الماء بدرجة قوة توتر سطحي مرتفعة جدًا ، وهذا يُفسر قدرة بعض أنواع الطيور على السير بأقدامها على سطح الماء .-درجة توصيلية الماء للحرارة مرتفعة عند المقارنة مع بعض المواد الأخرى مثل الزئبق ، غير أن الماء يبقى بصورته الطبيعية السائلة في درجات الحرارة المحصورة بين 0 إلى 100 سليزيوس .-ينتقل الماء إلى أعلى عبر الخاصية الشعرية ، وهذا ما يحدث في النباتات ، حيث يرتفع الماء من الأرض ويصل إلى السوق عبر الجذور لنقل المادة الغذائية بواسطة هذه الخاصية .-يُمكن الانتقال من أي حالة إلى أخرى للماء بسهولة ، وهناك اعتماد كبير على استخدام الماء في الحالات الثلاثة سواء الصلبة أو السائلة أو الغازية .نظرًا إلى أن الماء جزيء قطبي ؛ فإن الجزيئات ترتبط معها بعضها بقوة تماسك مرتفعة ، وهذا ما يحافظ على شكل الماء طوال الوقت خصوصًا في الحالة السائلة .-درجة حرارة الماء التي يُمكن استخدامها للشرب والري تتراوح بين 8 إلى 11 درجة مئوية .-يُعتبر الماء من المواد الانسيابية التي يمكنها أن تأخذ شكل الوعاء دون شكل محدد في الحالة السائلة ، وهي ذات درجة لزوجة منخفضة جدًا عند المقارنة مع مادة الزئبق .-المياه التي يتناولها الإنسان تحتوي على بعض العناصر الأخرى الهامة المرتبطة بها مثل الصوديوم والبوتاسيوم وهي مواد تُعزز من فوائد المياه الصحية .
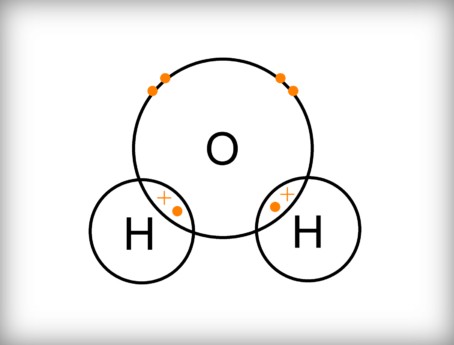
مكونات جزيء الماء
يتكون الماء بشكل أساسي من جزيئات مفردة ، حيث يحتوي كل جزيء على ذرة أكسجين واحدة مرتبطة مع ذرتين هيدروجين ، وقد أشار العلماء إلى أن الرابطة الموجودة في جزيء الماء هي رابطة تساهمية تنشأ من خلال مشاركة كل ذرة هيدروجين بإلكترون واحد مع 6 إلكترونات من الغلاف الخارجي لذرة الأوكسجين ، كما أن الصيغة الكيميائية لجزيء الماء هي : H2O ، والصورة التالية توضح بشكل أكبر بنية جزيء الماء[2]:
الماء مذيب عالمي
يُعتبر الماء هو أحد أهم المواد المُذيبة التي يُمكن من خلالها إذابة عدد هائل من المواد والحصول على محاليل الأملاح والعناصر وغيرهم ، وقد أشار علماء الكيمياء إلى أن الماء مُذيب عالمي نظرًا إلى الأسباب التالية[3]:-لا تتلخص قدرة الماء على إذابة عدد كبير من المواد فقط ، ولكنه قادر أيضًا على إذابة عدد كبير من المواد الأخرى التي لا يُمكن إذابتها باستخدام المذيبات الأخرى .-يحتوي الماء على أقطاب موجبة وأخرى سالبة ، وهذا سبب قدرة على إذابة المركبات الأيونية والجزيئات القطبية .-يعتبر الماء مذيب امن تمامًا ولا يُسبب أي أضرار بيئية أو صحية للإنسان ، وهذا سبب استخدمه على نطاق عالمي وفي أي مكان .-كما يمكن أيضًا الحصول على الماء المٌقطر Distilled water واستخدامه كمادة متعادلة أيضًا لإجراء الاختبارات الطبية وصناعة الأدوية وغيرهم من الاستخدامات الكيميائية الأخرى .-من خلال الماء يُمكن إذابة بعض المركبات العضوية التي تكون متعادلة والتي يكون بها بعض المركبات القطبية مثل المواد السكرية .-يوجد أيضًا عدد كبير من الأحماض وبعض المركبات القاعدية التي تذوب في المياه بقوة .ومن أهم مميزات استخدام الماء كمذيب عالمي أيضًا هو أنه متوفر في كل مكان ويمكن الحصول عليه بسهولة فائقة ، كما أن الماء المقطر يُمكن الحصول عليه من المتاجر أو الصيدليات بسهولة وباسعار منخفضة جدًا ، وهذا يُفسر إقبال عدد كبير من العلماء والباحثين على مستوى العالم على استخدام الماء كمذيب عند إجراء التجارب المختلفة .
مثال على استخدام الماء كمذيب
الماء مّيب غير عضوي فعال يمكن الاعتماد عليه في إذابة الكثير من الأملاح ومنها ملحكلوريد الصوديوم؛ حيث أن جزيء كلوريد الصوديوم (ملح الطعام) يتكون من ذرة كلور مرتبطة مع ذرة الصوديوم برابطة أيونية .حيث أنه عند إضافة هذا الملح إلى الماء ؛ تقوم بعض الأيونات الفردية بالتفاعل مع المناطق القطبية في جزيئات الماء أثناء عملية تفكك الروابط الأيونية ، حيث أن عملية التفكك تحدث عندما تنفصل ذرات أو مجموعات من الذرات من الجزيء وأن تقوم بتكوين الأيونات .وبالتالي عند إضاف كريستالات ملح الطعام NaCl إلى المياه ؛ ينقسم كلوريد الصوديوم إلى أيونات صوديوم موجبة Na+ (كاتيونات) وأيونات كلور سالبة Cl– ، وتتجمع كريات الماء حول الأيونات ، حيث ُحاط كاتيونات الصوديوم الموجبة بشحنة سالبة جزئية من ذرة الأكجسين الموجوة في جزيء الماء ، بينما تُحاط أيوناتالكلورالسالبة بشحنة موجبة جزئية من الهيدروجين الموجود في جزيء الماء .
هل الماء يُذيب جميع المواد
على الرغم من الفوائد والخواص الفريدة لجزيء الماء كمذيب غير عضوي ؛ إلا أنه يوجد بعض المواد التي لا يُمكن إذابتها في الماء ، مثل :
المراجع
- 1 - Physical Properties of Water .
- 2 - Water .
- 3 - Water’s Solvent Properties .




















