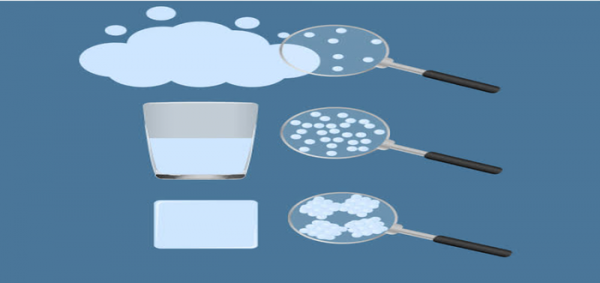
ما هي الجزيئات
على طوال السنين كان دائماًً ما يفكر العلماء في ما هو الشيء المتكونة منه الحياة ، و كان قديما يعتقد العلماء إن الحياة متكونة من هواء و نار و ماء فقط. لكن منذ بداية الحياة على الأرضر حتى وقتنا الحالي استمرت التطورات و مع مرور الوقت بدأ الفلاسفة في المباشرة بفكرة إن جميع الأشياء في الحياة متكون من أشياء صغيرة و جسيمات صغيرة لا يمكن تجزئتها ابداً .و بعدها اخذت هذه الفكرة بالعلماء إلى البحث و التأكد منها حتى ظهرت الكيمياء و النظرية الذرية و بعد إن اكتشفوا الجزيئات اطلقوا عليها أسم “moles” باللغة اللاتينية تعني الحاجز أو الكتلة .التعريف العلمي للجزيئات هو أصغر جسيم في المادة و يحتوي على خصائص المادة الفيزيائية و الكيمائية للمادة و التي تشمل الكثافة و الحجم و الكتلة ، و متكونة من ذرتين أو أكثر و مجموعات يمكن إن تكون مختلفة أو متشابهة جميعها مترابطة بعضها ببعض بواسطة قوى كيميائية.كل مادة في هذا العالم متكونة من جزيئات لكن تختلف حالات المادة و خصائص كل حالة من مادة إلى أخرى . و من خلال الجزيئات يمكننا مقارنة بين حالات المادة الصلبة و السائلة و الغازية .[1]
كيف تتكون الجزيئات
كل ذرة تتكون من نواة واحدة و تكون شحنتها موجبة و هذا النواة محاط بسحب ذات شحنة سالبة تتفاعل سحب الإلكترونات السالبة مع النواة ايضاً ، إذا كان هدف هذا التفاعل هو خفض الطاقة الإجمالية فسوف تترابط الذرت معاً لتكوين جزيء .فإن الجزيء يتكون من خلال تجمع ذرت التكافؤ تحت قوى شديدة . و توجد ايضاً جزيئات ثنائية الذرة أي تعني ذرتين مترابطتين كيميائياً و إذا كانت الذرتين متشابهتين ، على سبيل المثال ، جزيئ الأوكسجين (O2) مؤلف من جزيء ثنائي الذرة و متشابه النواة ، و على سبيل المثال ايضا ، جزيء أول أكسيد الكربون(CO) مؤلف من جزيء ثنائي الذرة لكن النواة غير متطابق .و يوجد ايضاً جزيئات متعددة الذرات ، على سبيل المثال ، ثاني أكسيد الكربون (CO2) هو جزيء متألف من آلاف الذرات و كذلك الماء (H2O) هو جزيئ متألف من آلاف الذرت ايضاً . من المهم جداً هو نسبة عدد الذرت التي يمكن ربطها لتكوين أي جزيء ، على سبيل المثال ، فجزيء الماء متكون من ذرتين هيدروجين و ذرة واحدة من الاوكسجين هذا هو الفرق بين المركبات الكيميائية و المحاليل الميكانيكية .و يتم تجميع الجزيئات بواسطة إلكترونات مشتركة أو بواسطة روابط كيميائية كالرابطة تساهمية أو الروابطة أيونية ، و الرابطة التساهمية و الرابطة الأيونية هما كالأتي :[1]الروابط التساهميةكما ذكرنا في الأعلى إن الروابط الكيميائية تجمع الذرات تحت قوى تجاذب شديدة ، و كذلك الروابط التساهمية حيث إنها تتشكل عند تفاعل إلكترونات التكافؤ ، و إلكترونات التكافؤ هي السطح الخارجي الإلكتروني في الذرة . التفاعل الحاصل بين الذرات يعتمد على السلبية الكهربية النسبية للذرة . و تبدأ الذرات ذات القدرة الكهربية المتشابهة بتشكيل رابطة تساهمية و في هذه العملية تتشارك كثافة إلكترون التكافئ في ذرتين ، إذا حدث فرق بين الكهربية و ذرات الروابط التساهمية قد تتشكل رابطة تساهمية قطبية.الروابط الأيونيةالرابطة الأيونية هي تجاذب بين أيونات كهربائية مختلفة لذرتين أو أكثر ، و عادة ما تحدث الرابطة الأيونية في معدن و لا فلز ، على سبيل المثال ، تجاذب أيونات الصوديوم و أيونات الكلور في كلوريد الصوديوم .[2]
هل هناك فرق بين أعداد الجزيئات الساخنة و الباردة
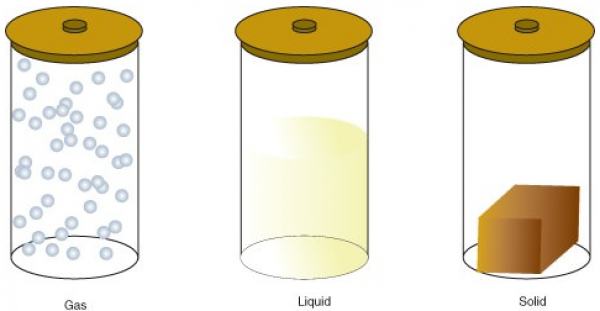
لا يوجد أي فرق بين أعداد الجزيئات في المادة فحالات المادة لا يمكنها تغيير أعداد الجزيئات لكن تستطيع تغيير حركة الجزيئات .على سبيل المثال ، البعض يسأل ماذا يحدث لمعظم المواد عندما يتم تسخينها ؟بحسب النظرية الحركية للذرات فإن كل ذرة و جزيء في المادة يتحركان بأستمرار .فإذا تعرضت أي مادة للحرارة تبدأ الجزيئات و الذرات بلأهتزاز بشكل أسرع من ذي قبل ، و عندما تهتز الجزيئات و الذرات ستبتعد الذرات عن بعضها البعض ، و حركات و مسافة الجزيئات و المادة هي التي تحدد ما هي المادة . و النتيجة لهذه الحركة الجزيئية ستتمد الذرات و تشغل مساحة أكثر .و إذا تعرضت جزيئات المادة إلى تبريد ستبدأ حركات الجزيئات و الذرات بالتحرك ببطئ شديد إلى إن تصل إلى حالة تسمى التجيمد و هي حالة تتحول فيها المادة من الحالة السائلة إلى الصلبة و يمكن لأي مادة سائلة إن تتجمد و تتحول صلبة بأستثناء مادة وحيدة و هي الهيدروجين السائل هذه المادة لا تتجمد عند تعرضها للتبريد بل تتجمد عند تعرضها لضغط حراري .و في بعض المواد لا تتحول من سائلة إلى صلبة ، يحدث العكس تتحول من صلبة إلى سائلة مثل النحاس عند تعرضة للتبريد و وصول درجة الحرارة إلى الانجماد يبدأ النحاس بتذويب نفسه و تسمى هذه الحالة بالتلاكؤ.[3]
ماذا يحدث إذا تساوى عدد الجزيئات في مادة ما في مكانين
ماذا يحدث إذا تساوى عدد الجزيئات في مادة ما في مكونين ؟ عادة ما يطرح هذه السؤال في امتحانات الفيزياء و الكيمياء يعد هذا السؤال صعباً و يطرحه الأستاذ ليرى قدرة الطالب .و الجواب هو: عند تساوي أعداد الجزيئات في مادة ما في مكونين تحدث حالة الاتزان .في هذه الحالة يكون معدل التفاعل الأمامي مطابق لمعدل التفاعل العكسي ، أي بمعنى إنه لا يوجد أي تغير صاف في المادة المتفاعلة و المنتجة و يعنى هذا إن عند تساوي عدد الجزيئات في مادة ما في مكونين لن يحدث أي تفاعل و أي تغير في المواد الناتجة نهائياً . و تعرف حالة الاتزان ايضاً بلاتزان الديناميكي .[5]
كيفية حساب عدد الجزيئات في المادة
من المهم عدد معرفة كم عدد الجزيء في أي مادة قبل إن تبدأ بتجربة تفاعل مادتين ، كما ذكرنا سابقا إذا حدث و تساوى عدد الجزيئات في مادة في مكونين لن يحدث أي تغير و لا أي تفاعل . لمعرفة عدد الجزيئات في مادة ما يجب عليك القيام بعدة خطوات للحصول على عدد الجزيئات في كل مادة و هذه الخطوات كالأتي : قياس كتلة المادةيجب عليك اولاً قياس كتلة المادة بالغرام ، على سبيل المثال ، كل عين من الماء تزن 36.0 غرام .حساب الكتلة الجزيئية للمادةحساب الكتلة المولية أو الجزيئية للمادة يمكنك حساب الكتلة عن طريق إضافة متوسط الكتل الذرية للذرات الفردية من خلال استخدام الجدول الدوري ، على سبيل المثال ، الكتلة المولية للماء هي 18 غرام لكل مول ، و الماء هو متكون من ذرتين هيدروجين تزن كل واحدة منهما 1.0 غرام و ايضاً على ذرة أوكسجين واحدة تزن 16.0 غرام .تقسيم الكتلة على الكتلة الجزيئيةاقسم الكتلة الذي حصلت عليها في أول خطوة فعلتها على كتلة الخطوة الثانية التي حصلت عليها ، هذه الخطوة تساعد في تغير وحدة المادة إلى مولات .الضرب في رقم أفوجادروقم بضرب الناتج التي حصلت عليه في الخطوة الثالثة برقم أفوجادرو ، و رقم أفوجادرو هو المول لجزيئات أي مادة .يعد 6.0221 × 1023 رقم أفوجادرو الثابت .[4]