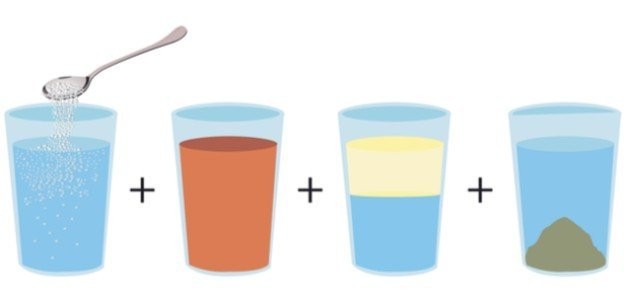
أمثلة على المخاليط المتجانسة
يُعرّفالمخلوط المتجانس (بالإنجليزية: Homogeneous Mixtureبأنّه خليط له تركيبة موحدة من حيث المظهر والمكونات بغض النظر عن مكان أخذ العينة، ويكون إمّا صلبًا أو سائلًا أو غازيًّا، ويَحتفظ المخلوط المُتجانس بِنفس التّركيب الكيميائي والشكل طوَال الوقت.[١]
أمثلة على المحاليل
يُعرّفالمحلول (بالإنجليزية: Solutions)بأنه خليط مُتجانس يَحتوي على مكونين أو أكثر، إذ يبلغ قُطر الجسيمات المذابة أقل من واحد نانومتر، ويُقسم المحلول إلى قسمين رئيسين: المُذيب والمُذاب.[٢]
أمّا المُذيب فمن اسمه هو المكوّن الذي يُذيب المكوّن الآخر في المحلول، وتكون نسبته العظمى في المحلول، بينما يُعرف المُذاب بأنّه المكون المذاب في المذيب وتكون نسبته أقل من نسبة المذيب في المحلول.[٢]
من الجدير بالذكر هنا أنّ المخاليط المتجانسة تُعرف أيضاً بالمحاليل، ومكونات المحاليل لا تقتصر على كونها سائلة فقط، إذ قد تكون خليط من سائل وغاز، أو سائل وسائل، أو سائل وصلب، أو غاز وغاز، أو صلب وصلب.[٣]
من المهم عند التطرق للمحاليل التفريق بينها وبينالمخلوط الغرويالذي يعرّف على أنه مخلوط تَمتزج فيه الجسُيمات المجهرية غير القابلة للذوبان مع مادة أُخرى، إذ تتوزع هذه الجُسيمات المجهرية بالتساوي ولا تترسّب في قاع المخلوط،
يعتقد البعض أن الحليب مخلوط مُتجانس خصوصًا المُعالَج في آلات، إذ تَمتزج جُزيئات الدهون في السائل، ولكن من الناحية الفنية يُعتبر الحليب مخلوط غروي تتعلق فيه جزيئات الدهون بين جزيئات الماء ولا تذوب فيها.[٥]
ومن الأمثلة على المحاليل السائلة أو التي تكون أحد مكوناتها كالمذيب أو المذاب سائلة[٦]،ما يلي:[٧]
- مُضاد التجمد المُستخدم في رديترات السيارة وهو مَحلول من الماء وجلايكول الإيثيلين. (سائل مع سائل)
- غَسول الفم. (سائل مع سائل)
- منظفات الغسيل السائلة. (سائل مع سائل)
- الخل وهو مَزيج من الماء وحمض الخليك. (سائل مع سائل)
- المُطهرات مثل معقم اليدين وهو خليط من الإيثانول والماء. (سائل مع سائل)
- بيروكسيد الهيدروجين وهو محلول من بيروكسيد الهيدروجين النقي مع الماء. (سائل مع سائل)
- الصابون السائل (سائل مع سائل)
- الكُحول في الماء (سائل مع سائل)[٨]
- البنزين في التولوين (سائل مع سائل)[٨]
- محلول ملحي. (سائل مع صلب)
- القهوة. (سائل مع صلب)
- محلول السُكر ومن أمثلتها المشروبات الرياضية. (سائل مع صلب)
- الماء المالح (سائل مع صلب).
- المشروبات الغازية وهي مزيج من الماء الفوار وثاني أكسيد الكربون، والسكر( سائل مع صلب مع غاز).
أمثلة على الغازات
يُعرف المحلول الغازي المُتجانس بأنّه المحلول الذي يكون الغاز أحد مكوناته على الأقل، ويُقسم إلى 3 أنواع: (غاز مع غاز) أو (غاز مع سائل) أو (غاز مع صلب).[٩]
ومن الأمثلة على المحاليل الغازية:[٩][١٠]
- الهواء الذي نتنفسه. (غاز مع غاز)
- الغاز الطبيعي. (غاز مع غاز)
- أحواض السمك. (غاز مع سائل)
- المشروبات الغازية التي تتكون من ماء وثاني أكسيد الكربون وسكر. (غاز مع سائل مع صلب)
- الماء الفوار التي يتكون من ماء وصودا وثاني أكسيد الكربون. (غاز مع سائل)
- أكسيد النيتروز المستخدم في التخدير. (غاز مع غاز)
- المسطحات المائية إذ يذوب الأكسجين في الماء. (غاز مع سائل)
- امتصاص الهيدروجين في البلاديوم هو عبارة عن معدن (غاز مع صلب)[٨]
أمثلة على المواد الصلبة
هي مخاليط متجانسة تتكّون من مواد صلبة، وتَتفاوت بين تشكلها بالطبيعة أو بطريقة مُصنعة.
ومن الأمثلة على المحاليلالصلبة[٩]، ما يأتي:[١٠]
- البرونز. (صلب مع صلب)
- سبائك الذهب. (صلب مع صلب)
- الفضة الإسترليني وهي سبيكة من الفضة والنحاس. (صلب مع صلب)
- البيوتر هي سبيكة من القصدير والأنتيمون والنحاس والبزموت. (صلب مع صلب)
- البيتومين وهو الشكل الصلب للبترول. (صلب مع صلب)
- الصلب هي سبيكة من الحديد والكربون. (صلب مع صلب)
- النحاس هي سبيكة من النحاس والزنك. (صلب مع صلب)
- اللدائن الحرارية وتتكون من البولي إيثيلين والبولي فينيل كلوريد. (صلب مع صلب)
أمثلة على المخاليط غير المتجانسة
يُعرفالمخلوط غير المتجانس (بالإنجليزية: Heterogeneous Mixture)بأنّه الخليط غير الموحد في المكونات والمظهر، أي يختلف توزيع مكوناته بالاعتماد على مكان أخذ العينة.[١١]
ومن الأمثلة على المخاليط غير المتجانسة:[١١]
- الزيت والماء.
- عصير البرتقال مع اللب.
- البيتزا.
- صحن من السلطة.
- صحن من المكسرات.
- سندويش.
- المياه الرملية.
- قوالب ثلجية مجمده مع الصودا.
الفرق بين المخاليط المتجانسة وغير المتجانسة
تختلف المحاليط المتجانسة عن غير المتجانسة من حيث سهولة فصل المكونات عن بعضها، بالإضافة إلى طرق الفصل[١٢]، وفي الجدول التالي توضيح لذلك:[١٣]
الفروق | المخاليط المتجانسة | المخاليط غير المتجانسة |
من حيث سهولة فصل المكونات عن بعضها البعض | صعب لأنها تتكون من مذيب ومذاب | سهل لأن رؤية مكونات الخليط أسهل |
من حيث طرق فصل المخاليط المتجانسة وغير المتجانسة | التبخر والتبلور:التي تستخدم لفصل مادة صلبة مذابة في سائل مثل فصل الملح عن الماء التقطير: التي تستخدم لفصل السوائل القابلة للذوبان مع بعضها مثل الماء والكحول. | الفصل بالمغناطيس:مثل فصل الحديد عن الألمنيوم. التصفيق أو التصفية:مثل فصل الماء عن الرمل باستخدام مرشح صغير المسام. الترشيح: باستخدام ورق الترشيح الذي يستخدم لفصل مادة صلبة عن السائل. |
ولمزيد من المعلومات عن العلاقة بين العناصر والمركبات والمخاليط، يُمكن الاطلاع على المقال الآتي: العناصر والمركبات والمخاليط .
ملخص المقال:
تختلف المخاليط المتجانسة عن غير المتجانسة من ناحية المكونات والمظهر، ,ويوجد كِلا النوعين من المخاليط في الحياة اليومية، وتُستعمل باستمرار في الأكل والشرب والتنظيف ولإنجاز كافة الأعمال المختلفة، ولا يقل أحدهما أهمية عن الآخر، وهناك العديد من الطرق الكيميائية التي تُستخدم لفصل كل من المخاليط المتجانسة وغير المتجانسة عن بعضها البعض، إذ يعتمد ذلك على طبيعة ونوع المخلوط الموجود.
المراجع
- 1 - Retrieved 19/8/2021.Edited " what-is-a-homogeneous-mixture-definition-and-examples " .
- 2 - Retrieved 19/8/2021 " what-are-homogeneous-mixtures " .
- 3 - Retrieved 19/8/2021.Edited " common-examples-of-solutions-science-in-everyday-life " , examples.yourdictionary .
- 4 - Retrieved 19/8/2021.Edited " what-are-homogeneous-mixtures " .
- 5 - Retrieved 19/8/2021.Edited " examples-of-homogeneous-mixture " , examples.yourdictionary .
- 6 - Retrieved 19/8/2021.Edited " examples-of-homogeneous-mixture " , examples.yourdictionary .
- 7 - Retrieved 19/8/2021.Edited " common-examples-of-solutions-science-in-everyday-life " , examples.yourdictionary .
- 8 - Retrieved 19/8/2021.Edited " solution-properties-concentration " .
- 9 - Retrieved 19/8/2021.Edited " common-examples-of-solutions-science-in-everyday-life " , examples.yourdictionary .
- 10 - Retrieved 19/8/2021.Edited " examples-of-homogeneous-mixture " , examples.yourdictionary .
- 11 - Retrieved 19/8/2021.Edited " what-is-a-heterogeneous-mixture-definition-and-examples " .
- 12 - Retrieved 19/8/2021.Edited " chemistry-separating-mixtures " .
- 13 - Retrieved 19/8/2021.Edited " METHODS FOR SEPARATING MIXTURES " .